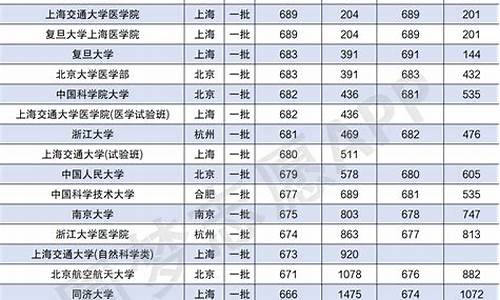
2013高考化学试题,2013年化学高考题
1.2013年广东省高考理科综合化学第31题第3小题第3小问不明白,盼您详细讲解分析,谢谢!
2.求一道2013福建高考化学题详解~

[Zn(NH3)4]cl2中的化学键类型为:
[Zn(NH3)4]2+ 与Cl-之间为离子键,所以含有共价键的只有[Zn(NH3)4]2+内部了:
1、Zn←N
4mol σ 配键
2、N-H
3* 4 = 12 mol σ 键
所以,每1mol的[Zn(NH3)4]2+中一共有 σ 键4+12 = 16mol(16NA)
其中配位键有4 mol(4NA)
2013年广东省高考理科综合化学第31题第3小题第3小问不明白,盼您详细讲解分析,谢谢!
1。配位数:离该粒子最近的粒子数,由图中可以看出,距离D最近的是面心的那六个粒子,所以配位数是6
2.A是氟,B是钾,C是铁
这个物质是 六氟和铁酸钾
首先这个复杂粒子是一个配离子,以高中生的知识来判断,铁应该是提供中心粒子,接受配体的,而钾和氟来说,氟的最外层有孤电子对,作为配离子。 再根据咱们见过的 铁氰化钾 来迁移,应该是六个配子。所以就是答案那个了
求一道2013福建高考化学题详解~
这个主要是平衡移动,反应物减少会使反应逆向移动,导致生成物也减少,这个反应的反应物是碘离子和溶液中的碘分子。随着反应进行,碘离子逐渐消耗,气态的碘分子增加导致溶液中碘分子减少,因此这两项都导致溶液中I3-减少。
B选项不符合温度升高反应速率加快。虽然从图中可看到b、c点的时间相同,但这时间是溶液变蓝的时间,并不完全是碘析出的时间,因为图中还能看出温度在10-40度之间时,温度升高反应速率加快,因此溶液变蓝时间即可视为碘析出时间。而温度在40度以上溶液变蓝时间并不等于碘析出的时间(这个信息题干中有叙述——“55度时未观察到溶液变蓝”)。所以b、c两点对应的亚硫酸氢钠反应速率并不相等。
C选项a点在10-40度之间符合温度升高反应速率加快,因此只要计算反应速率即为正确。
这样的解释不知能否接受。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。