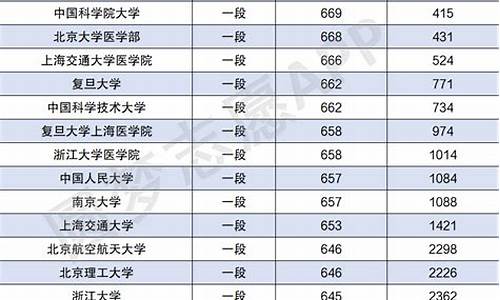
高考欧姆表题-高考欧姆表估读吗
1.高考中欧姆表不估读给不给分
2.高考物理的看图读数据类的题目哪些需要估读哪些不需要估读?
3.高中物理、化学实验仪器的读数问题
4.2009年高考天津卷(理综)试题
高考中欧姆表不估读给不给分

高考中欧姆表不估读不给分。
在高考评分标准中,对于欧姆表的读数,要求考生进行准确的估读。估读是一种测量方法,通过判断指针位置与刻度之间的关系,估计出最接近的十分之一位数值。这要求考生具备对测量仪器的正确使用和对测量结果的准确理解。如果考生没有进行估读,而只是简单地报告指针所在的刻度位置,评分标准不会给予分数。估读的目的是提高测量的精度和可靠性,确保测量结果更准确。
高考物理的看图读数据类的题目哪些需要估读哪些不需要估读?
供你参考吧:? (1)游标卡尺: 游标尺上每一小格与主尺上每一小格的差值即为精确度 所以游标卡尺不需要估读(2)机械秒表: 因为机械秒表采用齿轮传动 指针不会停留在两小格之间 所以不能估读出比0.1 s更短的时间 即机械秒表不需要估读 (3)欧姆表: 由于欧姆表的刻度不均匀 只作为粗测电阻用 所以欧姆表不需要估读 (4)电阻箱: 能直接读出接入电阻大小的变阻器 但它不能连续变化 不能读出比最小分度小的数值 所以电阻箱不需要估读
高中物理、化学实验仪器的读数问题
1、游标卡尺不需要估读
2、停表是机械表也不需要估读
3、多用电表读数:
一种是二分法估读。图1所示为0-0.6A量程的电流表刻度示意图,精确度为0.02A,二分法就是针对这种“2”类型精确度读数问题提出的,所谓二分就是把刻度上每1最小等分再2等分(每一等分就是“1”对应于图1就是0.01A),用该法读出的指针在a、b、c三处的读数分别为0.20A、0.29A、0.42A。
另一种是五分法估读。图2所示为0-15V量程的电压表刻度示意图,精确度为0.5V。这种情况就是把刻度的每一最小等分再5等分,所以指针在a、b、c三处的读数分别为5.0V、7.2或7.3V、10.5V。
4、多用电表读数时在1/3到2/3处读数较为准确
5、绝大多数仪器,最小分度是十分度的,都要估读到下一位。
化学仪器我不是很了解,你在问下别人。
2009年高考天津卷(理综)试题
一、单项选择题(每小题6分,共30分。每小题给出的四个选项中,只有一个选项是正确
-
的)
1.物块静止在固定的斜面上,分别按图示的方向对物块施加大小相等的力F,A中F垂直于
斜面向上。B中F垂直于斜面向下,C中F竖直向上,D中E竖直向下,施力后物块仍然
静止,则物块所受的静摩擦力增大的是
2.下列关于电磁波的说法正确的是
A.电磁波必须依赖介质传播 B.电磁波可以发生衍射现象
C.电磁波不会发生偏振现象 D.电磁波无法携带信息传播
3.为探究小灯泡L的伏安特性,连好图示的电路应闭合开关,通过移动变阻
器的滑片,使小灯泡中的电源由零开始逐渐增大,直到小灯泡正常发光。
由电流表和电压表得到的多组读数描给出的U-I图象应是
4.如图所示,竖直放置的两根平行金属导轨之间接有定值电阻R,质量不
能忽略的金属棒与两导轨始终保持垂直并良好接触且无摩擦,棒与导轨
的电阻均不计,整个装置放在匀强磁场中,磁场方向与导轨平面垂直。
棒在竖直向上的恒力F作用下加速上升的一段时间内。力F做的功与安
培力做的功的代数和等于
A.棒的机械能增加量
B.棒的动能增加量
C.棒的重力势能增加量
D.电阻R上放出的热量
5.如图所示,带等量异号电荷的两平行金属板在真空中水平放置,M、
N为板间同一电场线上的两点,一带电粒子(不计重力)以速度vM
经过M点在电场线上向下运动,且未与下板接触,一段时间后,粒
子以速度vN折回N点。则
A.粒子受电场力的方向一定在M指向N
B.粒子在M点的速度一定比在N点的大
C.粒子在M点的电势般一定比在N点的大
D.电场中M点的电势一定高于N点的电势
二、不定项选择题(每小题6分,共18分。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确。全部选对的得6分,选对但不全的得3分,选错或不答的得0分)
6.下列说法正确的是
A.衰变方程
B.是核裂变反应方程
C.是核裂变反应方程
D.是原子核的人工转变方程
7.已知某玻璃是蓝光的折射率比对红光的折射率大,则两种光
A.在该玻璃中传播时,蓝光的速度较大
B.以相同的入射角从空气斜射入该玻璃中,蓝光折射角较大
C.从该玻璃中射入空气发生反射时,红光临界角较大
D.用同一装置进行双缝干涉实验,蓝光的相邻条纹间距较大
8.某质点做简谐运动,其位移随时间变化的关系式为x=Asin,则质点
A.第1 s末与第3 s末的位移相同
B.第1 s末与第3 s末的速度相同
C.3 s末至5 s末的位移方向都相同
D.3 s末至5 s末的速度方向都相同
9.(18分)(1)如图所示,单项短形闭合导线框abcd全部处于磁感应强度为B的水平匀强磁场中,线框面积为S′电阻为R。线框绕与cd边重合的竖直固定转轴以角速度匀速转动,线框中感应电流的有效值I= 从中性的过程中通过导线横截面的电荷量q=
。
(2)图示为简单欧姆表原理示意图,其中电流表的偏电流f=300A,内阻Rg=100 ,要变电阻R的阻值为10 k,电池的电动势E=1.5 V,内阻l=0.5 ,图中与接线柱A相速的表笔颜色应是 色,接正确使用方法测量电阻Rx的阻值时,指针指在刻度盘的正中央,则Rx= k.
若该欧姆表使用一段时间内,电池电动势变小,内阻变大,但此表仍调零.按正确使用方法再测上述Rz,其测量结果与预结果相比较 (填“变大”、“变小”或“不变”)。
如图所示,将打点计时器固定在铁架合上,使重物应动纸带从静止开始自由下落,用此装置要吧测定重力和速度。
① 所需要材有打眯计时器(带导线)、纸带、复写纸、带铁夹的铁架台和带夹子的重物,此外还需 (填字母代号)中的器材。
A.直流电源、天平及砝码 B.直流电源、毫米刻度尺
C.交流电源、天平及砝码 D.交流电源、毫米刻度尺
② 通过作图象的方法可以剔除偶然误差较大的数据,提高实验的准确程度。为使图线的斜率等于重力加速度,除作v-t图象外,还可作 图象,其级轴表示的是
数轴表示的是 .
10.(16分)如图所示,质量m1=0.3 kg
③ 的小车在光滑的水平面上,车长L=15 m,现有质量m2=0.2 kg可视为质点的物块,以水平的速度v0=2 m/s从左端滑上小车,最后在车面上某处与小车保持相对静止。物块与车面间的动摩擦因数=0.5,取g-10 m/s2,求
(1) 物块在车面上滑行的时间t;
(2) 要使物块不从小车右端滑出,物块滑上小车左端的速度v′0不超过多少。
11.(18分)如图所示,直角坐标系xOy位于竖直平面内,在水平的x轴下方存在匀强磁场和匀强电场
,磁场的磁感应是B,方向垂直xOy平面向垂,电场线平行于y轴.一质量为m、电荷数为q的带正电的小球,从y轴上的A点水平向右抛出,经x轴上的M点进入电场和磁场能做匀速圆周运动,从x轴上的N点第一次离开电场和磁场,MN之间的距离为L,小球过M点时的速度方向与x轴的方向夹角为.不计空气阻力,重力加速度为g,求
(1) 电场强度E的大小和方向;
(2) 小球从A点抛出时初速度v0的大小;
(3) A点到x轴的高度h.
12.(20分)2008年12月,天文学家们通过观测的数据确认了银河系中央的黑洞“人马座A”的质量与太阳质量的倍数关系.研究发现.有一星体S2绕人马座A做桶圆运动,其轨道半长轴为9.50102天文单位公转轨道的半径为一个天文单位).
(1) 若将S2星的运行轨道视为半径r=9.50102天文单位的轨道.试估算人马座A的质量MA是太阳质量Ms的多少倍(结果保留一位有效数字):
(2) 黑洞的第二宇宙速度极大,处于黑洞表面的粒子即使以光速运动,其具有的动能也不足以克服黑洞对它的引力束缚.由于引力的作用,黑洞表面处质量为m的粒子具有势能为Ep=-G(设粒子在亮黑洞无限远处的势能为零),式中M、R分别表示黑洞的质量和半径.已知引力常量G=7.010-11N·m2/kg2,光速c=3.0108m/s,太阳质量Ms=2.01038kg,太阳半径Rs=7.0108m,不考思相对论效应,利用上间结果,在经典力学范围内求人马座A的半径R与太阳半径之比应小于多少(结果按大保留整数).
2009年普通高等学校招生全国统一考试(天津卷)
理科综合(化学部分)
理科综合共300分,考试用时150分钟
化学试卷分为第Ⅰ卷(选择题)和第Ⅱ卷两部分,第Ⅰ卷1至2页,第Ⅱ卷3至6页,共100分。
答卷前,考生务必将自己的姓名、准考号填写在答题卡上,并在规定位置粘贴考试用条形码。答卷时,考生务必相答案涂写在答题卡上,答在试卷上的无效。考试结束后,将本试卷和答题卡一并交回。
第Ⅰ卷
注意事项:
1.答小题选出答案时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦擦干净后,再选涂其他答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
以下数据可供答题时参考:
相对原子质量:H l Li 7 C 12 O 16 Br 80
1.化学与生活密切相关,下列有关说法正确的是
A.维生素C具有还原性,在人体内起抗氧化作用
B.糖类、蛋白质、油脂属于天然高分子化合物
C.煤经气化和液化两个物理变化过程,可变为清洁能源
D.制作航天服维和用于光缆爱信的光导纤维都是新型无机非金属材料
2. 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO3-3)均增大
3.下列实验设计和结论相等的是
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO2)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO2-4
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
4.下列叙述正确的是
A.0.1 mol/LC6H5ONO溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液和水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
5.人体血液内的血红蛋白(11b)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2O2+HbCO,37 ℃时,该反应的平衡常数K=220.
HbCO的浓度达到HbO2溶液的0.02倍,导致人智力受损。据此,下列结论错误的是
A.CO与HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
6.已知:2CO(g)+O2(g)=2CO2(g)
ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+
ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.下图可表示为CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(s)
ΔH>452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
2009年普通高等学校招生全国统一考试(天津卷)
理科综合 化学部分
第Ⅱ卷
注意事项:
1. 用黑色墨水的钢笔或或签字笔将答案写在答题卡上。
2. 2.本卷共4题。共64分。
(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期
IA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、⑧、⑦的价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由炭中元素形成的觉物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中阳M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
8.(18分)请他细阅读以下转化关系:
A.是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;
B.称作冰片,可用于医药和制香精,樟脑等;
C.的核磁共振氢 谱显示其分子中含有4种氢原子;
D. 中只含一个氧原子,与 Na反应放出H2O
F.为烃。
请回答:
(1) B的分子式为_______________________。
(2) B不能发生的反应是(填序号)______________。
a.氧化反应 b.聚合反应 c.消去反应 d取代反应 e.Br2加减反应.
(3) 写出D→E、E→F的反应类型:
D→E__________________、E→F_______________________。
(4) F的分子式为____________________。
化合物H是F的同系物,相对分子质量为56,写出H所有可能的结构;
_______________________________________________________________________。
(5) 写出A、C的结构简式并用系统命名法给F命名:
A:___________________________________,F的名称:________________________。
(6) 写出E→D的化学力程式
______________________________________________________________________。
9.(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
10.(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H22LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 。
2009年普通高等高等学校招生全国统一考试(天津卷)
理科综合 生物部分
第1卷
1. 下列选项中,两类细胞的染色体数目均可吃不开周期性变化的是
A. 蛙的红细胞与淋巴细胞
B. 小鼠骨髓瘤细胞与杂交瘤细胞
C. 人的胚胎干细胞与成熟红细胞
D. 牛的精细胞与精原细胞
2. 下列是有关科学家通过研究取得重要理论成果的叙述,正确的是
A. 虎克(R.Hooke)在显微镜下观察木栓组织发现蜂窝状“细胞”,建立了细胞学说
B. 坎农(W.B.Cannon)通过研究细胞内基因表达的过程,提出了内环境稳态概念
C. 摩尔根(T.H.Morgan)对雄果蝇白眼性状的遗传分析,证明了基因位于染色体上
D. 贝尔糠特(I.Wilmat)等在体外条件下将羊体细胞培养成了成熟个体,证明了哺乳动物体细胞的全能性
3. 下列过程中,涉及肽键数量变化的是
A. 洋葱根尖细胞染色体的复制
B. 用纤维素酶处理植物细胞
C. 小肠上皮细胞吸收氨基酸
D. 蛋清中加入NaCl使蛋白质析出
4. 下面为动物机体的细胞凋亡及清除示意图。
据图分析,不正确的是
A. ①过程表明细胞凋亡是特异性的,体现了生物膜的信息传递功能
B. 细胞凋亡过程中有新蛋白质合成,体现了基因的选择性表达
C. ②过程中凋亡细胞被吞噬,表明细胞凋亡是细胞被动亡过程
D. 凋亡相关基因是机体固有的,在动物生长发育过程中发挥重要作用
5. 下图表示气候变化对甲、乙生态系统中种群类型数量的影响。
据图分析,下列叙述正确的是
① 甲生态系统的抵抗力稳定性一定较乙生态系统强
② 甲生态系统中生物群落的营养关系一定较乙复杂
③ 乙生态系统在S点后一定有新的物种产生
④ 乙生态系统在S点后一定经历次生演替过程
A.①③ B.①④ C.②③ D.②④
6.按下表设计进行实验,分组后,在相同的适宜条件下培养8~10小时,并对实验结果进行分析。
实验材料
取样
处理
分组
培养液
供氧情况
适宜浓度
酵母菌液
50 mL
破碎细胞
(细胞不完整)
甲
25 mL
75 mL
无氧
乙
25 mL
75 mL
遇氧
50 mL
未处理
丙
25 mL
75 mL
无氧
丁
25 mL
75 mL
遇氧
下列叙述正确的是
A. 甲组不产生CO2而乙组产生
B. 甲组的酒精产量与丙组相同
C. 丁组能量转换率与丙组相同
D. 丁组的氧气消耗量大于乙组
2009年普通高等学校招生全国统一考试(天津卷)
理科综合 生物部分
第II卷
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共2题,共44分。
7.(14分)人的血型是由红细胞表面抗原决定的。左表为A型和O型血的红细胞表面抗原及其决定基因,右图为某家庭的血型遗传图谱。
血型
A
红细胞裂面A抗原
有
抗原决定基因
(显性)
O
无
(隐性)
据图表回答问题:
(1)控制人血型的基因位于 (常性)染色体上,判断依据是
。
(2)母亲血型不合易引起新生儿溶血症。原因是在母亲妊娠期间,胎儿红细胞可通过胎盘进入母体;剌激母体产生新的血基抗体。该抗体又通过胎盘进入胎儿体内,与红细胞发生抗原抗体反应,可引起红细胞破裂。因个体差异,母体产生的血型抗体量及进入胎儿体内的量不同,当胎儿体内的抗体达到一定量时,导致较多红细胞破裂,表现为新生儿溶血症。
①II-1出现新生儿溶血症,引起该病的抗原是 。母婴血型不合
(一定/不一定)发生新生儿溶血症。
②II-2的溶血症状较II-1重。原因是第一胎后,母体已产生 ,当相同抗原再次剌激时,母体快速产生人量血型抗体,引起II-2溶血加重。
③新生儿胃肠功能不健全,可直接吸收母蛋白,当溶血症新生儿哺母乳后,病情加重,其可能的原因是 。
(3)若II-4出现新生儿溶血症,其基因型最有可能是 。
8.(36分)水稻种子中70%的磷以植酸形式存在,植酸同铁、钙等金属高予离子或蛋白质结合排出体外,是多种动物的抗营养因子,同时,排出的大量磷进入水体易引起水华,
(1)磷元素除了形成植酸外,还可以出现在下列_____________分子或结构中(多选)。
A.核糖 B.ATP C.核糖体 D.核膜
(2)种植芦苇能有效抑制水华的发生,表进芦苇与引起水华的藻类关纱是_____________。
(3)植酸酶可降解植酸,在谷物类饲料中添加植酸酶可提高饲料的_____________利用率。
(4)酵母菌中植酸的活性较高。下图是从不同类型酵母菌的发酵液中提取植酸酶的工艺流程。
据图回答:
① 植酸酶________________(Ⅰ/Ⅱ)属于分泌蛋白。
② 若植酸酶Ⅰ和Ⅱ的肽链组成不同,其差异体现在______________________。
③ 提纯的植酸酶需做活性条件测定。右图为测结果。
图中的自变量可为_____________________________(答一种);
因变量可以通过测定______________________来表示。
(5)为从根本上解决水稻中的高植酸问题,可将植酸酶基因导入水稻,培育低植酸转基因水稻品种。下图是获取植酸酶基因的流程。
据图回答:
① 图中基因组文库____________(小于/等于/大于)cDNA文库。
② B过程需要的酶是______________;A、C过程中_____________(可以/不可以)使用同一种探针筛选含目的基因的菌株。
③ 目的基因Ⅰ和Ⅱ除从构建的文库中分离外,还可以分别利用图中___________。
和_____________为模板直接进行PCR扩增,该过程中所用酶的显著特点是_________________________。
(6)已获得的转植酸酶基因水稻品系植酸含量低,但易感病,下图为选育低植酸抗病水稻品种的过程。图中两对相对性形状分别由两对基因控制,并独立遗传。
采用上图育种过程,需从_______________代开始筛选,经筛选淘汰后,在选留的植株中低植酸抗病纯合体所占的比例是______________。选留植株多代自交,经筛选可获得低植酸抗病性状稳定的品性。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。